[별지 3]
[붙임]
다제내성결핵 치료 신약 사전심사 절차 및 방법
□ 심사 대상
○ 리팜핀내성/다제내성결핵*을 진료한 주치의가 신약 처방이 필요하다고 판단하여
신약 사용 전 심사를 요청하는 경우
* 다제내성결핵: 결핵환자로부터 분리한 균주가 이소니아지드와 리팜핀에 대해
생체 외 내성을 갖는 것
□ 심사 방법
○ 다제내성결핵 치료 신약 3종은 결핵 전문가로 구성된 심사위원회의 사전심사를
거쳐 건강보험 심사평가원의 급여 인정 여부를 결정
◆ 심사위원회 구성 및 운영
○ (구성) ‘대한결핵 및 호흡기학회*, 대한소아감염학회 및 대한감염학회** 추천 전문가 12인
* 최소 1인은 결핵전문병원(국립마산병원, 국립목포병원, 서울서북병원) 전문가 포함
** 심사 시 소아 환자는 소아감염학회, 폐외결핵 환자는 대한감염학회 위원 1인 필수 포함
○ (운영) 매 신청 건에 대해 심사(서면회의)하여 접수 익일로부터 업무일 5일 이내 결과 통보
○ (의결기준) 위원장 및 부위원장 포함 위원 12인 중 3인을 선정하여 심사 후
위원장 혹은 부위원장 1인이 최종 승인
- 단, 심사위원 소속 의료기관 신청의 경우 해당 위원은 선정 제외
○ (임기) 3년으로 하며 연임할 수 있다. 다만, 위원의 사임 등으로 인하여 새로 위촉된
위원의 임기는 전임 위원의 잔여기간으로 한다.
○ (이해관계 확인) 위원이 해당 의뢰에 대하여 증언, 진술, 자문, 연구, 용역 또는 감정을
한 경우, 위원이 해당 의뢰 기관 중 최근 3년 이내에 소속된 적이 있거나 소속된 경우
심의·의결에서 제척되며 위촉 시 이해관계확인서를 작성・제출한다(붙임6).
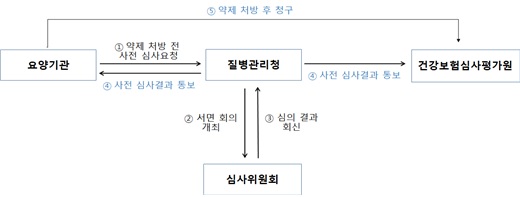
□ 심사 세부 절차
○ (사전심사 요청) 신약을 사용하고자 하는 요양기관은 사전심사요청서(붙임1)와
사전심사에 필요한 구비 서류*를 질병관리청 결핵정책과로 제출하여 심사요청
* 자세한 구비 서류 목록 및 제출 방법은 질병관리청「다제내성결핵 치료 신약
사전심사 안내」를 따름
○ (사전심사: 심사위원회)
- 사전심사위원회 서면회의 개최
→ 신약 요청 심사(심사위원회) 48시간 이내 회신(붙임2)
→ 접수 익일로부터 업무일 5일 이내* 심사 결과 관리 및 통보(질병관리청)
* 공휴일과 토요일 제외하며 추가 서류 제출이 필요한 경우 처리 기한 초과 가능
○ (사전심사 최종 결과 통보) 질병관리청은 요청 요양기관 및 건강보험 심사평가원에
사전심사 결과 통보
○ (사전심사 결과 확인 및 청구) 요청 요양기관은 사전심사 결과를 확인하고
약제 처방 후 건강보험 심사평가원에 급여 청구*
* 약제 사용 동의서(붙임3), 사전심사 결과 통보서(붙임4) 첨부하여 청구
□ 심사 기준
1) 서튜러(베다퀼린), 델티바(델라마니드)
○ (승인기준) 리팜핀내성/다제내성결핵 환자에 대하여 다음 조건을 만족하는 경우
사전심사를 거쳐 신약 사용 가능
- (허가사항) 기존의 항결핵약제로 적절한 치료계획 구성이 어려운 경우
- (허가사항 외*) 신약이 포함되어 적절한 치료계획 구성이 가능한 경우
* 폐외결핵, 소아 결핵, 24주 초과 투여, 연속 투여, 동시 투여 등
- 결핵 관련 국내·외 지침 등을 근거로 사전심사위원회가 유해성 대비 치료이익이 우세하다고 판단한 경우
○ (불허기준) ①신약이 포함되어도 적절한 치료계획 구성이 불가능한 경우, ②약제 사용 절대금기증에 해당하는 경우
○ (재심사) 치료계획에 중대한 변경 사항이 있는 경우 재심사 필요
※ 기타 자세한 사항은 질병관리청「다제내성결핵 치료 신약 사전심사 안내」를 따름
2) 도브프렐라(프레토마니드) 포함 병용치료
○ (승인기준) 성인의 광범위약제내성* 및 치료내성 또는 비반응성** 다제내성폐결핵
환자에 대하여 다음 조건을 만족하고, 베다퀼린, 리네졸리드와의 병용요법을 사용
하는 경우 사전심사를 거쳐 신약 사용 가능
* 이소니아지드와 리팜핀 내성이고 한 가지 이상의 퀴놀론계 약제 및 3가지 주사제
(카프레오마이신, 카나마이신, 아미카신) 중 한 가지 이상의 약제에 내성을 보이는 결핵
** 부작용 등으로 인해 적절한 2차 약제 처방을 사용할 수 없는 경우 또는 6개월 이상
2차 약제 처방으로 치료하였으나 반응이 없는 경우(객담 배양 음전 실패)
| ◆ 병용요법 용량 ○ 프레토마니드 1정(200mg)을 26주 동안 1일 1회 경구 투여 ○ 베다퀼린 400mg을 2주간 1일 1회 경구 투여 후, 투여 간격 최소 48시간으로 24주간 200mg을 주 3회 투여(총 26주) ○ 리네졸리드 1,200mg을 최대 26주 동안 매일 경구 투여, 이상반응(골수억제, 말초 및 눈의 신경병증)이 발생하는 경우 600mg, 이후 300mg으로 용량을 감량 또는 투여 중단 |
- (허가사항) 승인기준을 충족하고 약제 사용 절대 금기증이 아닌 경우
○ (불허기준) 약제 사용 절대 금기증에 해당하는 경우
○ (재심사) 치료계획에 중대한 변경 사항이 있는 경우 재심사 필요
※ 기타 자세한 사항은 질병관리청「다제내성결핵 치료 신약 사전심사 안내」를 따름
□ 경과보고서
○ (목적) 다제내성결핵 치료 신약을 투여한 환자에 대해 신약 사용의 효과성, 부작용 등을 파악하여 적정성 평가 실시
○ (방법) 신약 사전심사 승인/사용 환자를 진료하는 요양기관은 주기적으로 경과 보고서를 질병관리청으로 제출(붙임5)
- 경과 보고서를 기한 내에 제출하지 않은 요양기관은 제출 시까지 신약 사전심사 추가 신청 불가
※ 기타 자세한 사항은 질병관리청「다제내성결핵 치료 신약 사전심사 안내」를 따름
□ 후속 관리 방안
○ (적정성 평가) 사전심사요청서 및 경과 보고서를 기반*으로 신약 사용 적정성 평가 실시
* 필요시 결핵 신고자료 및 국민건강보험공단 등 외부 자료를 결합
- 부작용 발생 빈도, 치료 효과 등 주요 신약 사용 및 치료 관련 지표를 개발하여 정량적으로 평가
○ (정책 반영) 신약 사용 적정성 평가를 기반으로 다제내성결핵 환자 관리 정책에 반영
| 붙임1 | 사전심사 요청서 |
| 약제 구분 | □ 서튜러(베다퀼린) □ 델티바(델라마니드) □ 도브프렐라(프레토마니드) | ||||||||
| 재심사 여부 | □ 약제중단/변경 □ 24주초과사용 □ 연속사용(서튜러↔델티바) | ||||||||
| 환자 성명 | |||||||||
| 생년월일/연령 | / | 성별 | |||||||
| 사전심사 요청일 | 20 년 월 일 | 결핵종류 | □ 폐결핵 □ 폐외결핵( ) | ||||||
| 요양기관명 | 요양기관 번호 | ||||||||
| 진료의사 성명 | 면허번호 | ||||||||
| 환자 신장 | cm | 환자 체중 | kg | ||||||
| 환자 구분 | □ 신환자 (초치료자) □ 재치료 (□ 재발자, □ 실패 후 재치료자, □ 중단 후 재치료자, □ 이전 치료결과 불명확) □ 과거 치료여부 불명확 |
||||||||
| 항산균 검사 결과: 검체 종류 □ 객담 □ 객담외 ( ) | |||||||||
| 검체채취일(검사접수일) / 결과확인일 |
/ | / | / | / | / | / | |||
| 도말 | |||||||||
| 핵산증폭검사(TB-PCR) | |||||||||
| 배양(액체) | |||||||||
| 배양(고체) | |||||||||
| 혈액검사 결과 | |||||||||
| 검사 시행일 | . . | . . | . . | . . | |||||
| AST(IU/L) | RBC count(x106/μl) | ||||||||
| ALT(IU/L) | Hb(g/dl) | ||||||||
| BUN / Cr(mg/dl) | WBC count(x103/μl) | ||||||||
| Albumin(g/dl) | Platelets(x103/μl) | ||||||||
| K / Mg(mEq/L) | 흉부 X선 심각도 | □ 단측폐 □ 양측폐 | |||||||
| Ionized-Ca(mg/dl) | 공동 □ 유 □ 무 | ||||||||
| 부정맥 관련 위험인자 | |||||||||
| □ 없음 □ QT 연장 증후군 □ torsades de pointes □ 심실성 부정맥 □ 관상 동맥 질환 □ 저알부민혈증 # 심전도 결과: 검사일 ( . . ), QTcF 간격(msec) ( ) |
|||||||||
| QTcF 간격 연장 가능 약제 사용 여부 (결핵약 외 투여 약제) |
□ 예 (약제명: ) □ 아니오 |
||||||||
| 과거 치료력(기술) □ 없음 |
신고건의 사례조사서 내 기저질환을 포함하여 기술 | ||||||||
| 현재 치료 경과 | |||||||||
| 약제 감수성검사 결과 | ||||||||
| 항결핵약제 내성 코드 | [ ] * 광범위약제내성결핵, 광범위약제내성 전 단계 결핵, 다제내성결핵, 리팜핀단독내성결핵 |
|||||||
| 신속 감수성검사 (Genotype DST) |
실시간이중중합효소 연쇄반응검사 (Xpert MTB/RIF) □ 미실시/실시불가 □ 검사 중 |
검체채취일 / 결과보고일: ( . . ) / ( . . ) | ||||||
| 검체 종류 | □ 객담 □ 균주 □ 기타 ( ) | |||||||
| 검사 결과 | □ RIF 내성 | |||||||
| 1차약제 □ 미실시/실시불가 □ 검사 중 |
검체채취일 / 결과보고일: ( . . ) / ( . . ) | |||||||
| 검체 종류 | □ 객담 □ 균주 □ 기타 ( ) | |||||||
| 검사 결과 | □ H 내성 □ R 내성 | |||||||
| 2차약제 □ 미실시/실시불가 □ 검사 중 |
검체채취일 / 결과보고일: ( . . ) / ( . . ) | |||||||
| 검체 종류 | □ 객담 □ 균주 □ 기타 ( ) | |||||||
| 검사 결과 | □ FQ 내성 □ 주사제 내성 | |||||||
| 최종 Phenotype DST □ 미실시/실시불가 □ 검사중 □ 검사완료 |
핵심 약제 | Bdq/Dlm | □ 실시 □미실시 | |||||
| Lzd | □ 실시 □미실시 | |||||||
| 검체채취일 / 결과보고일: ( . . ) / ( . . ) | ||||||||
| 1차 | □H | □R | □E | □Z | ||||
| Group A | □Lfx | □Mfx | □Ofx | □Bdq(MIC__mcg/ml) | □Lzd | |||
| Group B | □Cs | □Cfz | ||||||
| Group C | □Am | □S | □Km | □Ipm/Cln | □Mpm | |||
| □Pto | □PAS | □Dlm(MIC_____mcg/ml) | ||||||
| 그 외 | □RFB | □INH-h | □T | □Pa(MIC__mcg/ml) | ||||
| 약물 사용력 (과거 1개월 이상 사용했던 약제 모두 체크) □ 없음 |
1차 | □H | □R | □E | □Z | |||
| Group A | □Lfx | □Mfx | □Ofx | □Bdq | □Lzd | |||
| Group B | □Cs | □Cfz | ||||||
| Group C | □Am | □S | □Km | □Ipm/Cln/Clv | □Mpm/Clv | |||
| □Pto | □PAS | □Dlm | ||||||
| 그 외 | □RFB | □INH-h | □T | □Pa | ||||
| 현재 사용 약제 □ 없음 |
1차 | □H | □R | □E | □Z | |||
| Group A | □Lfx | □Mfx | □Ofx | □Bdq | □Lzd(용량__mg/일) | |||
| Group B | □Cs | □Cfz | ||||||
| Group C | □Am | □S | □Km | □Ipm/Cln/Clv | □Mpm/Clv | |||
| □Pto | □PAS | □Dlm | ||||||
| 그 외 | □RFB | □INH-h | □T | □Pa | ||||
| 향후 치료 계획 약제 구성 |
1차 | □H | □R | □E | □Z | |||
| Group A | □Lfx | □Mfx | □Ofx | □Bdq | □Lzd(용량__mg/일) | |||
| Group B | □Cs | □Cfz | ||||||
| Group C | □Am | □S | □Km | □Ipm/Cln/Clv | □Mpm/Clv | |||
| □Pto | □PAS | □Dlm | ||||||
| 그 외 | □RFB | □INH-h | □T | □Pa | ||||
| 신약 사용 요청 이유 및 상세 치료 계획 기술 | ||||||||
| 20____년 ______월 ______일 질병관리청장 귀하 |
||||||||
| 심 사 의 견 | |||
| 사용가능 여부 | □ 사용 가능 | □ 사용 불가 | |
| 사용경과보고 (필요 시 체크) |
□ pDST 결과보고 | □ 신약 종료/24주 | □ 치료 종료 |
| 심사 의견 기술 (사용 불가 시 필수) |
|||
| 20____년 ______월 ______일 심사 위원 성명: (서명) |
|||
'요양급여심사기준' 카테고리의 다른 글
| 조혈모세포이식 실시기관 및 대상자 사전승인 등에 관한 세부사항」 공고 제정 안내 (건강보험심사평가원 공고 제2022-316호)/사전심사부/23.1.1 (1) | 2022.12.30 |
|---|---|
| (고시 제2022-313호) 「조혈모세포이식의 요양급여에 관한 기준」 전부개정 (0) | 2022.12.30 |
| 2022-312호 요양급여의 적용기준 및 방법에 관한 세부사항(약제)」 일부개정 안내/2023.1.1 (0) | 2022.12.30 |
| 2022-285호요양급여의 적용기준 및 방법에 관한 세부사항 일부개정/2023.1.1 (0) | 2022.12.22 |
| 2022-283호 요양급여의 적용기준 및 방법에 관한 세부사항 일부개정/23.1.1 (0) | 2022.12.22 |